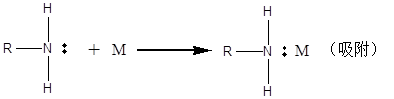有機緩蝕劑的作用機理
有機緩蝕劑分子中通常同時具有極性基團與非極性基團,極性基團中存在氮、氧、磷、硫等元素,這些元素均含有孤對電子,而且電負性大,有機緩蝕劑通過極性基團牢固地吸附在金屬表面上,而非極性基團排列在介質中,這樣一方面有效地隔離了金屬與腐蝕介質的接觸,阻礙了腐蝕反應產物的擴散,同時還改變了雙電層結構,提高了腐蝕反應的活化能,最終抑制了腐蝕反應的進行。有機緩蝕劑的緩蝕性能有賴于其極性基團在金屬表面吸附的強度,而極性基團的吸附可以是物理吸附也可以是化學吸附,或者兩種吸附共同存在。
(1)有機緩蝕劑極性基團的物理吸附
關于有機緩蝕劑的物理吸附行為,Mann最早做了深入的研究,他指出在酸性溶液中,吡啶(C5H5N)、烷基胺(RNH2)、硫醇(RSH)及三烷基磷等的中心原子(N、S、P等)含有孤對電子,這些中心原子與酸性溶液中的氫質子結合,最終形成陽離子:
RNH2+H+=(RNH3)+
形成的緩蝕劑與金屬之間存在的范德華力使緩蝕劑吸附在金屬表面,這就是物理吸附。物理吸附速度很快,是可逆過程,容易脫附,吸附過程產生的熱小,受溫度影響小,而且金屬和緩蝕劑間沒有特定組合。
物理吸附會受到金屬表面過剩電荷的顯著影響,如上所述,大多有機緩蝕劑在酸性介質中都以陽離子形式存在,如果金屬表面帶有過剩負電荷,那么金屬表面與緩蝕劑之間就會存在強烈的靜電引力作用,使得緩蝕劑更容易吸附在金屬表面,而且吸附作用力也更強;相反,金屬表面如果存在過剩的正電荷,則會一定程度上抑制緩蝕劑向金屬表面的吸附。金屬表面究竟攜帶何種過剩電荷,可以通過零電荷電位(即金屬表面沒有電荷存在時的電位)測量進行考察,零電荷電位可以通過微分電容曲線測試進行確定,即為金屬電極雙電層電容最小時的電位。當金屬開路電位大于零電荷電位時,金屬表面帶有過剩的正電荷,相反,金屬表面則帶有過剩的負電荷。在緩蝕劑的實際應用中可以通過改變金屬表面攜帶的過剩電荷量來促進緩蝕劑的物理吸附,如在酸性介質中,添加少量碘化物后,有機胺的緩蝕性能將為顯著提高,這主要是碘化物吸附在金屬表面后,使得金屬表面帶有更多的過剩負電荷,促進了有機胺類緩蝕劑在金屬表面的吸附;同樣有機胺類緩蝕劑之所以在鹽酸介質中有著卓越的緩蝕性能,也部分歸因于氯離子使得金屬表面帶有更多的過剩電荷。
(2)有機緩蝕劑極性基團的化學吸附——供電子型緩蝕劑
相比物理吸附來說,化學吸附作用力更強,吸附更穩定,因此大多數有機緩蝕劑與金屬表面的作用力主要是通過化學吸附實現的,而化學吸附實質就是緩蝕劑分子或離子與金屬表面原子之間形成了配位鍵。與物理吸附不同,化學吸附與金屬原子類別、緩蝕劑中心原子附近基團的推電子能力等均有密切關系。以鐵原子為例,鐵原子的核外電子排布為:{Ar}3d64s2,可以發現鐵原子中有空的d軌道存在,而緩蝕劑的中心原子如氮、氧、硫、磷等存在孤對電子,緩蝕劑中心原子的孤對電子會與鐵原子的d軌道形成配位鍵,通過配位鍵這種化學鍵的強作用力,使得緩蝕劑分子或離子牢固地吸附在金屬表面。通過配位鍵使得緩蝕劑在金屬表面發生的吸附,我們稱之為化學吸附。其作用過程如下:
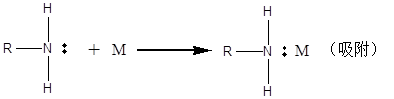
上世紀五十年代Hackerman首次提出了緩蝕劑的化學吸附,他指出由于N原子的孤對電子在金屬表面供電子能力存在差異,使得緩蝕劑在金屬表面可能存在不同的吸附,即物理吸附和化學吸附,相比物理吸附,化學吸附作用力更強、吸附更緩慢、受溫度影響顯著。經過后來的深入研究發現,在很多情況下緩蝕劑的吸附是物理吸附與化學吸附共同起作用的結果。如在酸液中,碳鋼表面帶有過剩負電荷,而有機胺類緩蝕劑在酸液中是以陽離子形態存在的,首先通過物理吸附使得有機胺陽離子靠近金屬表面發生吸附,然后氮原子上的孤對電子與金屬的d軌道形成配位鍵,通過配位鍵使得緩蝕劑分子牢固地吸附在金屬表面。
供電子型有機緩蝕劑的化學吸附作用力的大小取決于緩蝕劑分子中含孤對電子的原子上的電子密度,電子密度越高則越容易發生吸附,吸附更為牢固。因此當有機胺類化合物的胺基附近有推電子基團(如甲基),則會使得氮原子上的電子密度增加,更有利于氮原子與金屬形成配位鍵;相反,當胺基附近有吸電子基團(如硝基),則會使得成鍵能力下降。
(3)極性基團的化學吸附——供質子型緩蝕劑
藤井晴一通過實驗發現了緩蝕劑化學吸附的另外一種方式,即供質子型或質子給予型。這種緩蝕劑通過向金屬表面給予質子,從而使得緩蝕劑分子吸附在金屬表面上。例如在酸性介質中,十六硫醇的緩蝕性能要顯著優于十六硫醚,如圖1.4。
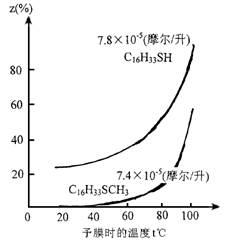
圖1.4硫醇和硫醚緩蝕性能的比較
硫醚分子中存在推電子基團(甲基),使得硫醚分子中的硫原子電子密度高于硫醇分子中硫原子的密度,根據供電子型吸附機理,硫醚的緩蝕性能應該優于硫醇的緩蝕性能。而硫醚具有很差的緩蝕效果這一實驗結果表明硫醇并不是通過供電子效應吸附在金屬表面。事實上硫醇是通過向金屬表面提供質子而吸附在金屬表面,由于硫原子電負性很高,使得與它相連的氫原子如同帶正電荷的質子一樣,吸附在金屬的陰極區。
(4)π鍵吸附
π鍵中的雙鍵或三鍵可以與金屬原子的d空軌道結合,形成配位鍵,從而使緩蝕劑分子吸附在金屬表面。如圖1.5所示。
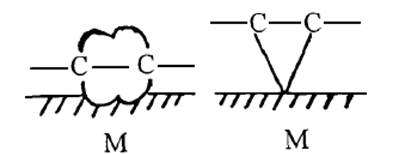
圖1.5 π鍵吸附
含有π鍵的化合物一般都具有較好的緩蝕效果,表1-1列出了一些含雙鍵化合物的緩蝕情況。
表1.1鋼在85℃的添加有雙鍵化合物的3mol/LHCI中的緩蝕率
緩蝕劑 |
丙胺 |
丙烯胺 |
丙酸 |
丙烯 |
乙酰胺 |
丙烯酰胺 |
緩蝕劑% |
18.9 |
33.6 |
23.6 |
46.9 |
21.0 |
72.3 |
從表中可以得知,分子中引入雙鍵后,由于π鍵的吸附作用,使得緩蝕性能顯著提高。含有π鍵緩蝕劑的取代基對其緩蝕性能有著顯著的影響,特別是當有極性基團靠近π鍵時,由于共軛作用而形成大π鍵,增強了緩蝕劑的吸附作用力,進而提高緩蝕性能。
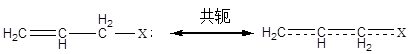
與雙鍵相似,含有三鍵化合物有具有較好的緩蝕劑效果,如表1.2。從表中可以看出,在酸性介質中,炔醇對金屬的緩蝕效果特別顯著,這是由于炔醇不僅可以發生π鍵吸附,特別是將羥基(-OH)引入到這類化合物中后,緩蝕性能更高。這是由于炔醇類緩蝕劑除了以π電子吸附在金屬表面外,同時與三鍵相鄰的氫原子非常活潑,可以向金屬表面陰極區提供質子,從而產生吸附。
表1.2鋼在85℃,添加三鍵化合物的15%HCI中的緩蝕率
緩蝕劑 |
空白 |
乙炔 |
庚炔 |
辛炔 |
癸炔 |
丙炔醇 |
己炔醇 |
腐蝕速度
(g/m2.h) |
790.4 |
56.0 |
47.2 |
51.1 |
96.5 |
6.09 |
0.42 |
緩蝕率
(%) |
—— |
92.9 |
94.0 |
93.5 |
87.8 |
99.2 |
99.9 |
|